하지만 CD47은 여러 면역관문 중 하나, 효능 의문
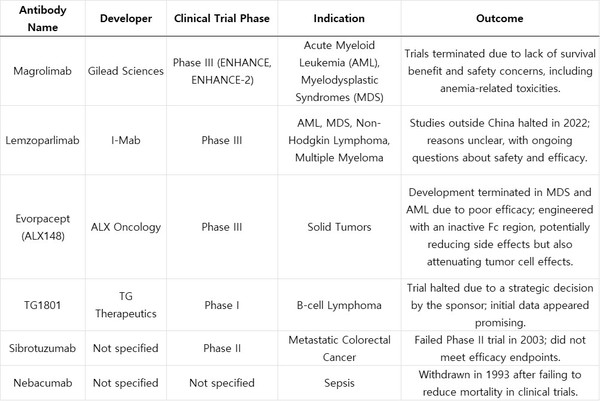
[프레스나인] CD47 항암제 실패의 주요 원인으로 혈액학적 독성이 첫째로 꼽힌다. CD47은 암세포뿐만 아니라 정상 적혈구에도 과다 발현된다. 항-CD47 항체가 빈혈 및 혈액 부작용을 유발하는 이유다. 그런데 이뮨온시아는 암세포 특이적으로 결합하는 항체를 개발했다고 주장한다. 정상세포에서 발현하는 CD47에는 붙지 않고 암세포에서 발현하는 CD47에만 붙는다는 것이다.
CD47은 모든 세포(적혈구, 면역세포, 혈관세포 등)에 존재한다. 항-CD47 항체는 암세포뿐만 아니라 정상 세포에도 영향을 줄 수 있다. 특히 적혈구에서 높은 수준으로 발현되기 때문에, 기존의 CD47 항체들은 빈혈 같은 부작용을 일으켰다.
암세포는 정상세포에 비교해 CD47을 과발현하지만 정상세포와의 차이가 극명하지는 않다. 따라서 CD47만 타깃으로 하면 정상세포도 일부 공격받을 위험이 있다. CD47은 정상세포에서도 높은 수준으로 존재해 차별화가 쉽지 않다.
이뮨온시아는 자체 항체 플랫폼을 활용해 암세포에서 발현하는 CD47에 더 특이적으로 결합하는 항체를 개발했다고 발표했다. 이뮨온시아의 IMC-002는 임상1a상에서 독성 문제 없이 목표 용량까지 도달했다. 그동안 부작용으로 알려진 백혈구나 혈소판 감소 같은 혈액학적 독성 문제가 발생하지 않았다.
암세포 특이적으로 CD47을 억제하는 방법은 몇 가지가 있다. 암세포 특이적 CD47 변이 또는 구조 차이 활용하는 방식과 SIRPα를 활용하는 방식이 있다.
암세포에서 발현된 CD47이 정상세포에서 발현된 CD47과 미세한 구조적 차이가 있을 수 있다. 특정 당화(Glycosylation) 패턴이나 콘포메이션(3D 구조) 차이를 이용해 선택적으로 결합하는 항체를 만들 수 있다. 하지만, 이러한 차이가 존재한다고 해도 크지 않기 때문에 완전한 암세포 특이성을 확보하기에 어려움이 있다.
암세포에서 발현하는 SIRPα의 가장 중요한 기능은 CD47과의 상호작용을 통해 면역세포의 식균 작용을 억제한다. SIRPα는 CD47과 결합하면 인산화 반응을 통해 대식세포의 식균 작용을 억제하기 때문에 CD47-SIRPα 결합이 유지되면 대식세포는 해당 세포를 공격하지 않는다. SIRPα 같은 보조인자를 이용해 암세포에 더 선택적으로 결합하도록 항체를 설계할 수 있다. 이뮨온시아의 방식은 CD47-SIRPα 축을 차단하는 방식으로 판단된다.
그런데 CD47의 문제는 부작용뿐만 아니라 효능이 입증되지 못했다는 것이다. 따라서, 이뮨온시아의 기술이 암세포 특이적으로 결합하는 항체라고 해도 효능에 대한 데이터가 확인 되어야 한다.
CD47 타깃 항체들이 아직 효능을 보여주지 못한 이유는 면역관문이 CD47만 있는 것이 아니기 때문이다. PD-1, CTLA-4, LAG-3, TIGIT, TIM-3 등 면역관문은 많다. 이들 중 단독으로 가장 큰 효과를 보여준 것은 PD-1이다. CD47이 단독으로 키트루다(Keytruda) 항-PD-1보다 더 좋은 효능을 보여주기는 어려워 보인다.
CD47은 암세포의 여러 면역 회피 기전중에 하나이기 때문에 대표적 면역관문인 PD-1을 억제 해야 효능을 보일 가능성이 높다. 그러나 항-PD-1 항체와 병용을 하게 되면 독성이 더욱 증가할 수 있어 신중한 접근이 필요하다는 의견이다. 또한, 다른 면역관문 억제제들이 병용 투여되었을 때 키트루다 단독 투여보다 월등이 좋은 효능을 보여줄지도 미지수다.