고분자량 + 지용성 성향이 동시에 존재해 DAR↓
조기 방출될 가능성 높아
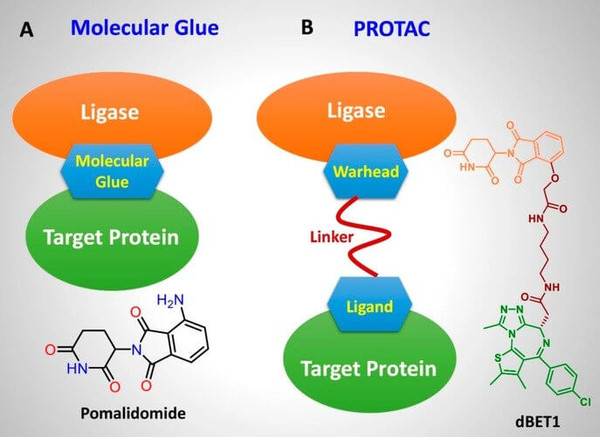
[프레스나인] 오름테라퓨틱 입장에서 분자접착제를 대체해 PROTAC을 ADC 페이로드로 설계하는 접근은, 개념적으로는 상당한 매력과 가능성을 지닌 전략처럼 비춰질 수 있다. 그런데 실제로 구현하는 데는 여러 기술적·화학적·생물학적 제약이 따른다.
우선 PROTAC은 일반 소분자 약물에 비해 훨씬 크고 무겁다. 일반적인 항암제 페이로드는 분자량이 500 Da 전후인 반면, PROTAC은 700~1,500 Da 이상으로 상당히 크다. 이는 항체와의 결합 효율을 떨어뜨릴 뿐만 아니라, DAR(Drug-to-Antibody Ratio)을 높이는 데 한계를 준다. 즉, 페이로드가 커질수록 항체당 부착할 수 있는 수량이 줄어들어 약효 저하 가능성이 있다.
PROTAC은 일반적으로 높은 지용성(lipophilicity)과 복잡한 구조를 가지고 있어 구조적으로 불안정한 경우가 많다. 또한, 이런 이유로 ADC의 혈중 안정성을 저해할 수 있으며, 체내에서 약물이 조기기 방출되거나 비효율적으로 전달될 수 있다. 이런 비특이적 방출은 독성 증가를 초래할 수 있다. 또한, 지용성이 높은 PROTAC은 항체 표면에 다수 부착될 경우 수용성 저하와 함께 응집(aggregation)을 유발하여 제형 안정성 및 생체 내 반응성을 떨어뜨리는 주요 원인이 될 수 있다. 이러한 물리화학적 제약은 PROTAC을 ADC 페이로드로 활용할 때 반드시 고려해야 할 중요한 도전 요소이다.
또한, PROTAC은 구조가 정밀하고 민감한 분자이기 때문에, 링커에서 정확하게 잘 떨어져 나와야만 제 역할을 할 수 있다. 만약 링커가 세포 안에서 제대로 분해되지 않거나, 분리 과정에서 PROTAC의 구조가 손상되면, 목표 단백질을 분해하는 본래 기능을 잃고 효과가 없게 될 수 있다. 즉, PROTAC의 약효는 링커로부터의 정확하고 온전한 분리에 크게 의존한다.
마지막으로 PROTAC을 페이로드로 사용했을 때 상업 생산이 쉽지 않아 보인다. PROTAC 자체가 구조적으로 복잡하며, 합성 과정이 길고 수율이 낮은 경우가 많다. 여기에 ADC 결합까지 하게 되면 화학적 제형화 공정이 훨씬 어려워지고, 산업적 생산성 확보에 제약이 커진다.
PROTAC을 ADC의 페이로드로 사용하는 것은 이론적으로는 가능하지만, 실용화를 위한 장벽이 매우 높다. 크기, 안정성, 기작의 복잡성, 세포 내 전달 방식, 그리고 제조상의 문제까지 고려할 때, PROTAC 기반 ADC는 현재로선 매우 도전적인 전략이다. 오름테라퓨틱이 이런 문제점들을 극복할 수 있는 링커 기술을 포함한 새로운 플랫폼을 완성할 수 있을지 의문이다.