항서제약, 후기 임상인 위/식도암·난소암·유방암·전립선도 후보
[편집자주]HLB가 약 5000억원을 투입해 15년 동안 개발한 항암제 '리보세라닙'의 운명이 두달 앞으로 다가왔다. 리보세라닙의 미국 진출기와 앞으로 남은 과제를 진단해 보고자 한다.
[프레스나인] HLB가 간암치료제 '리보세라닙'의 미국 허가 이후 후속 임상 파이프라인으로 간암 보조요법과 담관암 치료제를 유력하게 검토하고 있다. 빠르게 상업화가 가능한 물질에 재원을 집중 투자하겠다는 방침이다.
HLB는 리보세라닙과 '캄렐리주맙'이 비절제성/전이성 환자 대상 간암치료제로 미국 허가 여부를 앞두고 다양한 후속 임상 진행 방안을 검토 중에 있다.
유력한 후보는 리보세라닙과 캄렐리주맙의 간암 수술 후 '보조요법(adjuvant therapy)'으로 적응증 확장이다. 보조요법은 간암 수술을 마친 환자를 대상으로 재발을 막기 위한 목적으로 사전 처방하는 치료제다. 수술 가능한 간암 환자의 재발률은 3년과 5년에 각각 50%와 70%로 높은 것으로 알려진다.
HLB는 간암 보조요법으로 바로 미국 임상 3상 진행이 가능할 것으로 예상하고 있다. FDA는 이미 승인된 약물(리보세라닙과 캄렐리주맙 간암 병용요법)이 안전성을 이미 확보하고 있고, 작용 기전이 새로운 적응증과 인과성이 있다고 판단하면 1~2상을 건너뛰고 3상을 바로 승인하기도 한다.
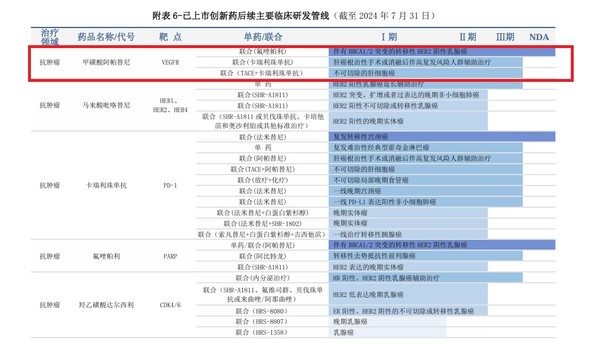
항서제약이 동일 적응증으로 대규모 3상을 막바지 진행하고 있다는 점도 3상 직행 가능성을 높이는 요인이다. 항서제약은 2020년 착수한 중국 환자 687명 대상 리보세라닙과 캄렐리주맙의 간암 수술 후 보조요법 3상 투약을 지난해 완료해 올해 허가 신청을 앞두고 있다.
HLB는 항서제약의 중국 임상 데이터를 확보하면 FDA와 즉각 미국 3상 계획을 수월하게 협의할 수 있다고 판단하고 있다. 실제, 간암치료제 1차의 경우 항서제약이 중국에서 2상까지 진행했던 데이터에 기반해 FDA로부터 3상을 승인받아 시간과 비용을 획기적으로 단축했다.
HLB가 미국 나스닥 상장기업 릴레이 테라퓨틱스로부터 도입한 담관암 2차 치료제 'RLY-4008'도 바로 상업화가 가능한 후보물질이다. RLY-4008은 FDA로부터 혁신치료제(breakthrough therapy)로 승인받아 완료된 2상 결과를 바탕으로 신약허가 신청(NDA)이 가능하다. HLB는 올해 상반기 FDA와 신약허가 신청 전 미팅(Pre-NDA)을 진행할 예정이다.
이밖에 항서제약이 선제적으로 임상을 진행하고 있는 조합도 모두 HLB가 타깃으로 삼을 수 있는 후보물질이다. 항서제약은 ▲BRCA1/2 돌연변이가 있는 전이성 HER2 음성 유방암(리보세라닙+플루조파립) ▲진행성 또는 전이성 위암 또는 위식도암(리보세라닙+캄렐리주맙+옥살리플라틴+카페시타빈) ▲절제 불가능한 간세포암종(리보세라닙+캄렐리주맙+화학색전술(TACE))은 중국 3상을 진행하고 있다. 전이성 거세저항성 전립선암(리보세라닙+플루조파립)은 2상을 완료하고 3상 진입을 앞두고 있다.
HLB 관계자는 "간암신약 허가 후 간암 분야에서 적응증 확장을 추진할 예정"이라며 "향후 항서제약과 협의를 통해 적응증에 대해 글로벌 임상 확대를 진행할 것"이라고 말했다.