[프레스나인] HLB테라퓨틱스가 개발 중인 신경영양성각막염(NK) 치료제 'RGN-259'의 유럽 임상 3상 톱라인(topline) 데이터가 조만간 도출될 전망이다.
HLB테라퓨틱스 파트너사인 미국 리제넥스(RegeneRx)는 최근 주주서한에서 이같이 밝혔다. 리제넥스는 HLB테라퓨틱스와 공동투자한 합작법인 리젠트리(Regentree)를 통해 RGN-259 개발에 참여하고 있다.
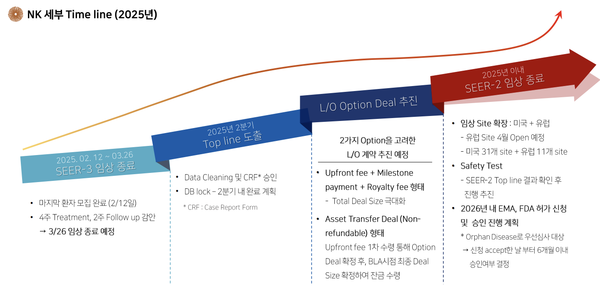
RGN-259는 현재 유럽 임상 3상(SEER-3)과 미국 임상 3상(SEER-2) 중이다. 유럽 임상 3상의 경우 올해 3월 참여한 마지막 환자의 약물 투여 및 2주간의 추적관찰이 종료되며 최종 분석 단계에 돌입했다. HLB테라퓨틱스는 가장 많은 시간이 소요되는 후속 데이터 점검 과정을 최대한 단축해 톱라인 결과를 조속히 도출한다는 방침을 내놓은 바 있다.
리제넥스는 “6월 말까지 유럽 임상 3상의 톱라인 데이터를 확보할 수 있을 것으로 예상한다”며 “6월 환자 모집단의 눈가림해제(unmasking)를 준비하기 위해 환자 데이터베이스를 검토하고 있다. 결과를 기다리는 동안 제3자와의 논의는 계속 진행 중이다”고 전했다.
이어 “미국 임상 3상 톱라인 데이터는 내년 초 확보할 수 있을 것”이라며 “모든 것이 순조롭게 진행되면 내년 말까지 미국에서 바이오의약품 허가 신청(BLA)을 제출하는 것을 목표로 한다”고 말했다. 리젠트리는 BLA 신청에 필요한 안전성 연구를 위한 프로토콜을 준비하고 있는 것으로 전해졌다.
HLB테라퓨틱스는 RGN-259의 톱라인 수령 후 기술수출에 속도가 붙을 것으로 기대하고 있다.
회사는 앞서 기업설명회를 통해 올해 안에 라이선스 옵션 계약(License Option Agreement)을 체결한다는 목표를 제시했다. 계약에 대해서는 2가지 방안이 제시됐다. 먼저 계약 초기에 계약금, 마일스톤, 로열티를 모두 합친 형태로 전체 딜 사이즈를 극대화하는 방식이다. 두 번째는 반환 불가능한 자산 이전(Asset Transfer Deal)을 추진해 계약금 수령과 옵션 딜을 확정하고, 이후 신약허가(BLA) 시점에 최종 딜 사이즈를 확정해 잔금을 수령하는 것이다.
톱라인 데이터가 긍정적일 경우 순조롭게 기술수출 파트너사를 확보할 수 있을 것으로 보인다. RGN-259는 현재 미국에서 유일한 신경영양성각막염 치료제로 쓰이는 돔페(Dompé)의 ‘옥서베이트’에 비해 투약 과정이 간편하고 투여기간도 짧은 등 환자 편의성이 높은 것으로 평가된다. 가격 측면에서도 경쟁력이 충분하다는 시선이 나온다.