美 알렉터, 동일 타깃 항체 AL002 임상 2상 실패...개발 중단
AL002, 수용성 TREM2에 결합해 효과 저하...비질 VG-3927는 달라
[프레스나인] 프랑스 사노피(Sanofi)가 신규 파이프라인을 인수해 알츠하이머병 타깃 TREM2를 공략한다. TREM2는 앞서 미국 알렉터(Alector)가 임상 2상에서 고배를 마신 타깃이다. 사노피가 확보한 파이프라인은 알렉터의 것과 타깃은 같지만 작용 기전이 다르다는 점에서 기대감을 모으고 있다.
사노피는 최근 알츠하이머병 신약개발사 비질뉴로사이언스(Vigil Neuroscience, 이하 비질)를 4억7000만달러에 인수한다고 밝혔다. 지난해 6월 비질에 4000만달러를 투자한 뒤 약 1년 만이다. 인수는 3분기 마무리된다.
비질은 경구용 저분자 TREM2 작용제 VG-3927를 개발한다. 앞서 VG-3927은 임상 1상에서 안전성이 확인됐고 1일 1회 25mg 용량 기준 뇌척수액 내 수용성 TREM2(sTREM2)를 약 50% 줄이는 효과를 보였다.
VG-3927의 임상 결과에 어떤 의미가 있는지 이해하려면 먼저 TREM2의 작용에 대해 알아야 한다.
TREM2는 중추신경계(CNS)의 미세아교세포(microglia) 표면에 발현하는 수용체다. 미세아교세포는 선천 면역세포로 평상시에는 뇌 속 주변 환경을 탐지하고 손상된 신경세포나 이물질, 감염원으로부터 뇌세포를 보호한다. 알츠하이머병의 주요 원인 물질인 아밀로이드베타(Aβ) 단백질을 감지하면 활성화돼 포식·분해하는 청소부 역할을 하는데 이때 TREM2가 Aβ를 감지한다.
그래서 여러 신약개발사가 TREM2를 활성화해 미세아교세포의 작용을 강화하는 기전의 약물을 연구하는 중이다. 알렉터의 TREM2 항체 AL002도 그 중 하나였다. 그러나 AL002는 임상 2상에서 고배를 마셨다. 지난해 11월 발표에 따르면 알츠하이머병 진행 지연이라는 1차 평가지표를 충족하지 못했고 그밖의 유의미한 효과도 관찰되지 않았다. 이에 따라 개발이 중단됐다.
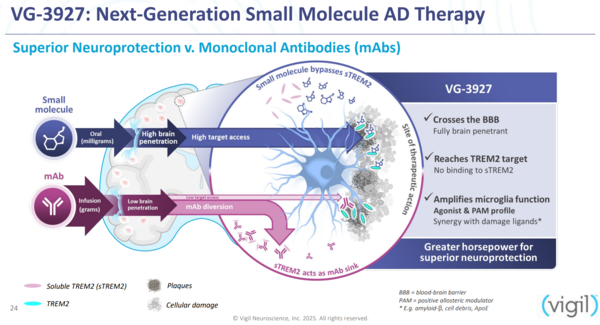
AL002가 실패한 이유는 TREM2에 제대로 결합하지 못해서라는 게 비질 측의 주장이다. TREM2는 계속 미세아교세포에 붙어있는 게 아니다. 일정 시간이 지나면 체내 효소에 의해 분리돼 sTREM2로 떨어져나온다. 그런데 AL002는 TREM2뿐 아니라 이 sTREM2에도 결합하는 것으로 분석됐다. 특히 아밀로이드베타 단백질 포식을 위해 미세아교세포가 모인 곳에서는 sTREM2 농도가 높아 AL002와 TREM2의 결합이 어려운 것으로 파악됐다.
AL002와 달리 비질의 VG-3927은 항체가 아닌 저분자의약품으로, sTREM2와 결합하지 않고 TREM2에만 작용한다. VG-3927이 TREM2와 결합해 내재화를 촉진하면 자연히 분리되는 TREM2 개수가 줄면서 sTREM2도 감소하게 된다. 즉 VG-3927 임상 1상에서 뇌척수액 내 sTREM2이 감소했다는 것은 약물이 TREM2에 잘 결합했다는 뜻으로 해석된다.
비질은 “VG-3927은 염증을 증가시키지 않으면서 응집된 아밀로이드와 타우 단백질에 대한 미세아교세포의 보호 반응을 향상시키도록 설계됐다”며 “항체 TREM2 작용제와 달리 sTREM2에 결합하지 않기 때문에 수용체를 활성화하고 미세아교세포 기능을 극대화할 수 있다”고 밝혔다.
사노피는 이같은 VG-3927의 특징을 고평가한 것으로 보인다. 비질 인수를 진행하는 한편 후속 임상에 나설 것으로 예상된다. VG-3927는 올해 3분기 임상 2상에 진입할 예정이다.
다만 VG-3927이 실제로 알츠하이머병 치료효과를 보일지는 두고 볼 일이다. TREM2 및 sTREM2의 작용에 대해 아직 명확하지 않은 부분이 많기 때문이다. 여러 연구에 따르면 sTRME2도 미세아교세포를 활성화하고 아밀로이드베타 응집을 차단하는 등 체내에서 나름의 역할을 지닌다(2022, Guy C. Brown). sTRME2 농도를 줄이는 VG-3927의 작용이 알츠하이머병 진행에 어떤 영향을 미칠지 주목되는 이유다.