아카순리맙-키트루다 병용요법, 비소세포폐암 2상서 간 부작용 나타나
한미약품 BH3120, 아카순리맙 대비 간 독성 낮아...치료효과 입증이 과제
[프레스나인] 한미약품의 PD-L1/4-1BB 타깃 이중항체 치료제 BH3120은 기전이 같은 경쟁 물질이 적지 않다. 그중 가장 유망한 물질로 평가받던 것이 덴마크 바이오텍 젠맙(Genmab)의 아카순리맙(acasunlimab, 개발명 GEN1046)이다. 공동개발 파트너사가 메신저리보핵산(mRNA) 기술로 유명한 독일 바이오엔텍(BioNTech)이라는 점에서 특히 주목받았다.
그러나 최근 아카순리맙의 개발은 먹구름이 드리워진 모양새다. 지난해 아카순리맙 임상 2상 초기 결과가 도출된 뒤 바이오엔텍이 돌연 공동개발을 중단한다고 밝힌 것이다. 이에 업계에서는 바이오엔텍이 아카순리맙의 간 독성 데이터를 부담스러워했던 게 아니냐는 분석이 나온다. 아울러 아카순리맙과 기전이 같으면서도 더 낮은 독성을 내세우는 한미약품 BH3120에 시선이 모이고 있다.
아카순리맙 임상 2상은 비소세포폐암 환자를 대상으로 아카순리맙 단독요법 및 아카순리맙-키트루다(성분명 펨브롤리주맙) 병용요법(3주간격/6주간격)을 평가하는 내용이다. 지난해 미국임상종양학회(ASCO)에서 발표된 초기 결과에 따르면 병용요법 치료효과는 준수했다. 종양 평가가 가능한 병용요법 6주간격 투여 환자 38명을 대상으로 전체생존기간 중앙값(mOS) 17.5개월, 객관적반응률(ORR) 30% 등을 기록했다.
하지만 간 독성이 만만찮게 나타났다. 병용요법 3주간격 투여 환자군의 28.6%, 6주간격 투여 환자군의 18.4%가 간 관련 이상반응(liver-related events)을 겪었다. 3등급 이상 이상반응의 비중은 각각 16.7%, 12.2%였다. PD-L1/4-1BB 타깃 이중항체의 목적 중 하나가 간 독성을 낮추는 데 있다는 것을 고려하면 아쉬운 데이터다.
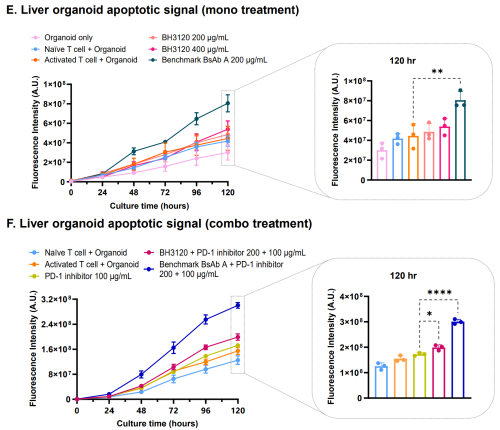
한미약품은 BH3120이 아카순리맙보다 낮은 독성을 보일 것으로 자신하고 있다. 전임상을 통해 일찌감치 비교 데이터를 선보인 바 있다. 간 오가노이드 모델에서 BH3120과 아카순리맙 단독요법 및 두 약물과 키트루다 병용요법을 각각 테스트한 결과 아카순리맙 쪽의 간세포 사멸이 훨씬 높게 나타났다. ALT(Alanine aminotransferase) 등 간 건강을 나타내는 다른 지표에서도 비슷한 결과가 나왔다.
이제 인간 임상에서 안전성과 치료효과를 확인할 차례다. 한미약품은 BH3120 단독요법 임상 1상을 진행하는 한편 BH3120/키트루다 병용요법의 임상 1상을 추진하는 중이다. 아카순리맙의 안전성을 보완한 이중항체의 등장 가능성이 엿보인다.
애초 PD-L1/4-1BB 타깃 이중항체는 4-1BB 타깃 단일 항체의 간 독성 문제를 해결하기 위해 나온 아이디어다. 면역세포에서 발현하는 4-1BB는 T세포 증식, 사이토카인 생성 등에 관여한다. 간은 특히 면역세포가 풍부한 기관으로, 4-1BB의 작용으로 면역작용이 일정 이상 강해질 경우 간 독성이 발생할 수 있다. 실제로 BMS가 개발한 4-1BB 항체 우렐루맙(urelumab)이 간 독성 문제로 임상 중단된 사례가 있다.